
- Proč některé kapaliny vedou elektrický proud a jiné ne?
- Jak funguje plochá baterie?
- Proč lze akumulátor znovu nabít?
Výroba el. napětí/proudu: El. proud v kapalinách - elektrolýza Faradayovy zákony elektrolýzy Další praktická použití elektrolýzy Fotodioda Hallův jev Alternátor Generátor trojfázového napětí Trojfázová soustava napětí Transformátor Přenosová soustava
 |
|
Vezměme nádobu, upevněme do ní dvě kovové desky a ty připojme přes ampérmetr ke zdroji napětí. Do nádoby nalijme destilovanou vodu. Elektrický proud obvodem neprochází. Osolíme-li vodu, začne proud obvodem procházet. Na pokus se můžete podívat na video ¤ (soubor *.rm, 501 kB; ev. soubor *,avi ¤ 2786 kB). Jak toto pozorování vysvětlit?
Destilovaná voda nevede elektrický proud, protože v ní nejsou přítomny žádné volné částice s nábojem. Pokud do ní nasypeme sůl (chemicky NaCl), proběhne elektrolytická disociace - NaCl se rozloží na ionty Na+ a Cl-. To už jsou volné částice s nábojem, proto po přiložení napětí obvodem elektrický proud prochází.
Něco k názvosloví: Kapalina, která vede elektrický proud, se nazývá elektrolyt, vodivé desky, které jsou do ní ponořené a ke kterým je připojen zdroj napětí, jsou elektrody. Kladná elektroda je anoda, záporná katoda. Kladné ionty se nazývají kationty (jsou totiž přitahovány ke katodě), záporné ionty pak anionty (viz obr. 1).
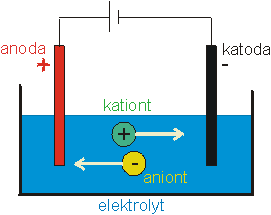
obr. 1: Názvosloví
Jiný příklad vedení elektrického proudu v kapalinách
(elektrolytech) je tento:
elektrolyt modrá skalice (CuSO4)
anoda: měď
katoda: uhlík
Probíhají tyto reakce:
Elektrolytická disociace: CuSO4 ---> Cu2+ + SO42-
Na katodě: Cu2+ + 2e- ---> Cu
(měď z roztoku získá od katody dva elektrony a vylučuje se na ní)
Na anodě: SO42- ---> SO4 + 2e-
SO4 + Cu ---> CuSO4
(SO4 odevzdá anodě dva elektrony a "vezme si" z ní jeden
atom mědi - anoda se rozpouští)
Koncentrace elektrolytu se nemění (jedna molekula CuSO4 je na začátku reakce a rovněž jedna molekula CuSO4 je na konci).
Toto je základ průmyslové metody zvané galvanické pokovování - nanášení tenkých vrstev jiného kovu na nějaký vodivý povrch (např. chromované kliky, nárazníky, ...). Předmět, který chceme pokovit, se použije jako katoda, kov, kterým budeme pokovovat, jako anoda a elektrolyt bude sůl tohoto kovu (v našem případě jsme pokovovali mědí, tedy elektrolyt byl CuSO4).
Změříme-li voltampérovou charakteristiku, zjistíme, že platí Ohmův zákon U = RI (U je napětí na elektrolytu, I proud jím procházející a R je odpor elektrolytu). Odpor elektrolytu se chová stejně jako odpor kovů ¤ - když k sobě elektrody přiblížíme, odpor klesá (zmenšuje se "délka vodiče"), když nalijeme více elektrolytu, odpor rovněž klesá (zvětšuje se "průřez vodiče"). Na pokus se podívejte na video ¤ (soubor *.rm, 441 kB; ev. soubor *,avi ¤ 2553 kB).
Udělejme další pokus. Jako elektrolyt použijeme zředěnou kyselinu sírovou (H2SO4), jedna elektroda bude zinková a druhá měděná. K elektrodám připojíme voltmetr (obr. 2). Na pokus se podívejte na video ¤ (soubor *.rm, 240 kB; ev. soubor *,avi ¤ 1527 kB).
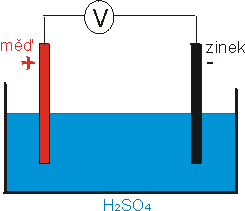
obr. 2: Měděná a zinková elektroda v roztoku H2SO4
Voltmetr ukazuje napětí mezi elektrodami 1 V, přičemž
zinková elektroda je záporná a měděná kladná. Jak toto napětí vzniká?
Měděná elektroda se v kyselině rozpouští. To znamená, že kladné ionty
(jádro + valenční elektrony) mědi přecházejí do elektrolytu (vodivostní
elektrony v kovech tvoří elektronový plyn a zůstávají v elektrodě).
Elektroda se tak nabíjí záporně a elektrolyt kladně.
Zinková elektroda se rovněž v kyselině rozpouští a nabíjí se tak záporně.
Zinková elektroda se však rozpouští mnohem více, a proto je "zápornější"
než měděná elektroda. Měděná elektroda má tedy vyšší potenciál než
zinková a mezi oběma elektrodami je tudíž elektrické napětí. Spojíme-li
je vodičem, protéká jím elektrický proud (obr. 3).
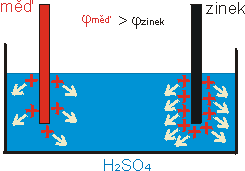
obr. 3: Rozpouštění měděné a zinkové elektrody v kyselině sírové.
Rozpouštěním přechází do kyseliny kladné ionty a elektrody se nabíjí záporně.
Zinková elektroda se rozpouští více a její potenciál je tedy menší než
potenciál měděné elektrody.
Tato dvojice elektrod je tedy zdrojem elektromotorického napětí.
Obecně vzniká napětí mezi dvojicí elektrod z různého materiálu,
které jsou ponořeny do elektrolytu. Podobně fungují i monočlánky
(tužkové baterie). V nich je jako katoda použita zinková nádobka, jako
anoda uhlíková tyč. Ta je obklopena směsí burelu a uhlíku, která slouží
jako depolarizátor. Průchodem proudu elektrolytem totiž probíhá elektrolýza
a na elektrodách se usazují sloučeniny, které snižují napětí mezi nimi.
Článek se tak vybíjí. Depolarizátor zpomaluje usazování sloučenin a
prodlužuje tak životnost článku.
Jako elektrolyt je v článku salmiak (NH4Cl), který je zahuštěn
škrobem a má tak kašovitou konzistenci (obr. 4).
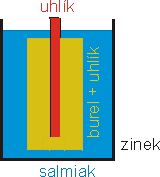
obr. 4: Monočlánek skládající se z uhlíkové tyčinky (anoda), zinkové nádoby
(katoda), salmiaku (elektrolyt) a burelu s uhlíkem (depolarizátor). Salmiak je
shora zalit krycí hmotou (není zakreslena) a uhlík je opatřen kovovou čepičkou.
Tento článek dává napětí 1,5 V. Potřebujeme-li větší napětí, použijeme plochou baterii dávající napětí 4,5 V. Tato baterie obsahuje tři monočlánky spojené do série (obr. 5).
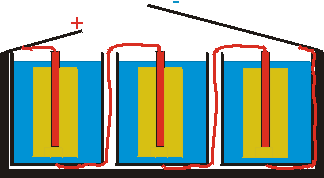
obr. 5: Plochá baterie - sériové spojení tří monočlánků
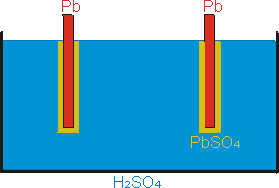
Monočlánek nelze po vybití znovu nabít. Zdroj stejnosměrného napětí, který lze nabíjet, se nazývá akumulátor. Například olověný akumulátor vytvoříme vložením dvou olověných elektrod do elektrolytu - zředěné kyseliny sírové. Na elektrodách vznikne vrstvička PbSO4. Povrch obou elektrod je ze stejného materiálu, akumulátor je vybit (obr. 6). Elektrolyt je disociován na H+ a SO42-.
Připojíme-li elektrody ke zdroji vnějšího napětí, probíhají
následující chemické reakce:
Na katodě: 2H+ + 2e- ---> 2H
2H + PbSO4 ---> Pb + H2SO4
Na anodě: SO42- ---> SO4 + 2e-
SO4 + PbSO4 + 2H2O ---> 2H2SO4
+ PbO2
Hustota elektrolytu se zvyšuje (na jednu molekulu H2SO4 na začátku reakce jsou tři molekuly H2SO4 na konci). Na katodě se spotřebovává vrstvička PbSO4 a zůstává tak čisté olovo, na anodě se PbSO4 mění na PbO2. Jakmile se spotřebuje celá vrstvička PbSO4 na katodě, začne se na ní vylučovat plynný vodík (už nemá s čím reagovat). to je znamení, že akumulátor je nabit (obr. 7). Napětí mezi elektrodami je 2,1 V. Když je nyní spojíme přes zátěž, bude obvodem protékat proud.
 |
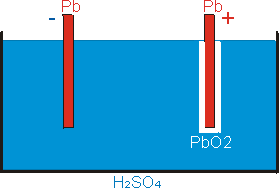 |
| obr. 6: Vybitý olověný akumulátor. Obě elektrody jsou obaleny PbSO4. | obr. 7: Nabitý olověný akumulátor. katoda je čisté olovo, anoda je pokryta PbO2. |
Průchodem proudu se akumulátor vybíjí (probíhají opačné chemické reakce než při nabíjení a elektrody se opět pokrývají vrstvičkou PbSO4). Po vybití ho můžeme zase znovu nabít.
Další: Faradayovy zákony elektrolýzy ¤